Rigor y ética: Claves esenciales en el camino regulatorio de los candidatos vacunales cubanos

El proceso de diseño y desarrollo de los candidatos vacunales cubanos ha estado acompañado de estrictas regulaciones y la rigurosidad ética por las autoridades reguladoras en el país, lo cual ha garantizado la seguridad en los ensayos clínicos y estudios de intervención, así como las buenas prácticas de producción.
Directivos del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) y del Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) comparecieron en la Mesa Redonda de este jueves para informar sobre estas premisas esenciales en el camino de los candidatos vacunales.
El Cecmed tiene amplia experiencia en la certificación y el registro de vacunas

La subdirectora del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed), Danay Mora Pascual, comenzó la Mesa Redonda destacando las fortalezas de su autoridad como entidad reguladora.
Mora Pascual dijo que el Cecmed es un sistema regulador establecido mediante la implementación de seis funciones básicas de la Organización Mundial de la Salud (OMS), como son, el autorizo de los ensayos clínicos de las vacunas, la aprobación de un registro o uso de emergencia, la licencia de establecimientos, la vigilancia post-comercialización, la liberación de lotes y el acceso a laboratorios (LNC).
Con 32 años de creado, aseguró que el Cecmed «tiene mucha experiencia en la certificación y registro de vacunas. Nuestro país es productor de vacunas y de productos biotecnológicos, los de mayor complejidad en el desarrollo de medicamentos para uso humano».
La subdirectora mencionó a entidades como el Instituto Finlay y el CIGB, que han contribuido a que la autoridad se crezca en las fortalezas de sus capacidades reguladoras.
«No solo es una fortaleza tener las seis funciones implementadas, también la capacidad y la preparación de nuestros especialistas, quienes provienen de diferentes disciplinas. Tenemos médicos, farmacéuticos, microbiólogos, virólogos, químicos, radiofísicos, entre otros», valoró.
Estos mismos especialistas han sido convocados como expertos por la Organización Panamericana de la Salud (OPS) y la OMS para participar en la elaboración de guías regulatorias que estos organismos desarrollan.
La subdirectora apuntó que el Cecmed pertenece a organizaciones que se reúnen y discuten la actualización de sus normativas y destacó la experiencia de Cuba en la producción de vacunas.
«Tenemos dos vacunas precalificadas, contra la Hepatitis B y la sintética contra el Haemophilus influenzae tipo B. Somos referencia regulatoria por la OPS y por la OMS, porque no existe una vacuna que se precalifique si su autoridad no está reconocida como madura y capaz de verificar y fiscalizar ese producto».
Reiteró que el Cecmed tiene toda una base legal que lo respalda y que es actualizada. «Entre ellos, los requisitos de nuestras guías, las cuales están aliniadas con las regulaciones de otros países, y se tienen en cuenta para las vacunas contra la covid-19″.
«Sin embargo, -apuntó- por el proceso acelerado que han tenido todos los candidatos vacunales o vacunas,» las organizaciones reguladoras se han reunido y han establecido requisitos particulares para estas aprobaciones».»
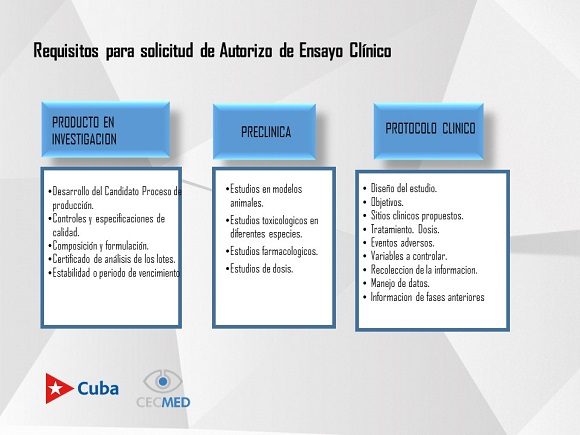
Con respecto a nuestros candidatos vacunales, señaló que «se dice que se basan en plataformas tecnológicas conocidas para agilizar estos mismos procesos y requisitos, como estos reportes interinos de eficacia que es lo que se tendrá en cuenta para una aprobación de autorizo de uso de emergencia.
«Estos procesos acelerados -añadió- han sido posible porque hemos adaptado los procesos formales de lo que es un expediente, pero los requisitos técnicos, recomendados para este tipo de candidatos, sí están ahí. Existe una celeridad en los procesos que requiere de más esfuerzo y tiempo de nuestros especialistas, que no pueden obviar la calidad«.
«Nunca ha existido -afirmó- una propuesta que haya salido limpia y clara. Nosotros siempre tenemos comentarios y observaciones que hacer. Nosotros verificamos qué se presenta y qué calidad tiene, si cubre el requisito técnico que se le está verificando. Hacemos reuniones técnicas y los fabricantes responden a estos comentarios y viabilizamos el entendimiento».
Precisó que en el caso de los candidatos vacunales cubanos, incluso antes de comenzar los estudios en humanos, el Cecmed tuvo intercambios con la industria, «un procedimiento que se ajustó para hacer el proceso de forma más ágil. Intercambios donde los fabricantes nos presentaban sus estrategias, qué pretendían con cada fase de ensayo clínico y qué nivel de completamiento tenían de la información».
Al comentar sobre el dato de eficacia del candidato vacunal que el Cecmed tiene que avalar, añadió que no solo implica eso, sino «un módulo de calidad que habla del proceso productivo del candidato y los controles de calidad. También todo lo relacionado con ensayos de toxicología en modelos animales y un módulo que va dirigido a los estudios que se han hecho propiamente en humanos y todas sus fases.
«Esto -puntualizó- se hace a largo plazo porque tiene que seguirse la seguridad del sujeto. Los efectos adversos no siempre aparecen al principio. Nuestros dos candidatos han demostrado ser bastante seguros, por lo cual hay que monitorearlos en el tiempo y el tiempo es largo».
La subdirectora del Cecmed dijo que una parte importante es «verificar lo que el fabricante pone sobre el papel. Se hacen las inspecciones para verificar que el proceso productivo es tal cual lo están presentando.
«Para la aprobación de los ensayos de nuestros candidatos se conformaron equipos de hasta cinco inspectores. También se verifica el cumplimiento de las buenas prácticas clínicas en la ejecución del diseño del ensayo y su adherencia a los protocolos.
«Por ejemplo, -explicó- hemos tenido que decirle al fabricante: «no estamos de acuerdo con esta propuesta de diseño, tienes que modificarlo». Eso a los productores les cuesta un poco de trabajo porque tienen un pensamiento que es llegar más rápido a la aprobación de sus productos. Pero no es una meta, es una responsabilidad muy grande que hay detrás de cada decisión que tomamos. Las decisiones se toman en el mundo en base a un balance riesgo-beneficio, pero la responsabilidad es grande y siempre en función de la protección de la salud humana».
Mora Pascual se refirió a los ensayos en niños, los cuales están siendo aprobados por el Cecmed «luego de tener una data importante de seguridad y de inmunogenicidad en los adultos. Incluso el propio ensayo que es de 3-18 años tiene un desescalado de edad, es decir, se comienza con los de 12-18 y siete días después de aplicadas la primera dosis en este grupo, nosotros recibimos un informe parcial y es cuando podemos aprobar la continuidad para aplicar la vacuna a los más pequeños, de 3-11 años», explicó.
Todos los ensayos clínicos que se han aprobado han sido inspeccionados
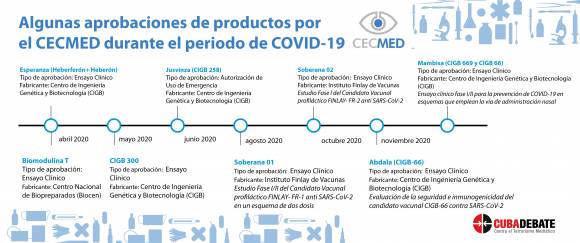
Al intervenir en el espacio televisivo, la Dra. C. Diadelis Remírez Figueredo, Investigadora Titular del Departamento de Registros del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed), sostuvo que la situación pandémica ha representado un reto para las autoridades reguladoras y el Cecmed no ha estado exento.
Ello, dijo, ha estado relacionado con el gran volumen de ensayos clínicos en los cuales hemos analizado hipótesis similares, diseño, manejo de datos etc., pero ello no ha comprometido la supervisión regulatoria y ética de estos ensayos.
«Es preciso destacar que durante toda esta etapa el Cecmed ha tenido como política que todos los ensayos clínicos que se han aprobado han sido inspeccionados. Nos hemos trasladado incluso a las provincias, donde se desarrollaron los ensayos del candidato vacunal Abdala, para poder verificar cómo ha sido la ejecución de ese ensayo clínico que nosotros aprobamos», explicó Remírez Figueredo.
La especialista subrayó que en varios escenarios se ha hablado de rigor, y que este no es más que la exactitud y precisión con la que se realiza determinada actividad. «El Cecmed lo ha hecho de esa forma, y cada paso ha estado respaldado por el rigor científico. Estas inspecciones de buenas prácticas clínicas tienen como objetivo fundamental, verificar la total adherencia a ese protocolo que la autoridad reguladora evaluó y aprobó, luego de debates e intercambio regular con la industria», dijo.
Ese protocolo»agregó, que no es más que un documento donde se describe e ilustra todo el diseño y metodología del ensayo clínico, las consideraciones éticas, estadísticas y la conducción de dicho estudio que luego de ser aprobado, debemos inspeccionar en el sitio clínico donde se desarrolla, para comprobar en condiciones reales qué sucede.
La investigadora señaló que las buenas prácticas clínicas no son más que normas que aseguran la confiabilidad de todos los datos que se generan y sobre todo la seguridad de ese sujeto que está participando en un ensayo clínico, en aras de garantizar que esos datos sean confiables de cara al posterior manejo de los mismos para obtener resultados veraces en los estudios de eficacia y seguridad.
Remírez Figueredo señaló que otra de las funciones del Cecmed es» la certificación de los sitios clínicos que antes de la ejecución de los ensayos ya han sido evaluados.» Durante las inspecciones a los sitios clínicos, dijo, se verifica que el sujeto sea evaluado por un personal competente con experiencia en buenas prácticas clínicas.

«Luego ese sujeto se dirige hacia el sitio de vacunación, donde cumpliendo las buenas prácticas de enfermería se le administra el producto de investigación. En todo ese proceso debe haber trazabilidad. Algunos de los servicios esenciales que evaluamos durante el desarrollo de un ensayo clínico es la farmacia, el lugar a donde llega ese producto de investigación, que debe venir con un certificado del análisis del lote, con los registros de temperatura correspondientes, con toda una serie de documentación que nosotros verificamos», comentó la investigadora.
Otro de los servicios evaluados por la autoridad reguladora es el laboratorio clínico y de inmunología, donde se realizan las determinaciones de la muestra que se le ha extraído al sujeto y que es de vital importancia, ya que es procesada por personal competente, que no conoce si es muestra de sujeto placebo o vacunado, porque son estudios a ciegas, puntualizó.
«El equipo de inspección está conformado también por especialistas en laboratorio clínico que verifican todos los registros del laboratorio, qué se hace con las muestras, qué parámetros se miden con ellas, entre otros elementos, y todo esto forma parte del rigor de los ensayos. Incluso el Cecmed tiene accionar sobre la jeringuilla y aguja con la cual se administra el producto de investigación en ese deltoide, pues son productos que deben estar registrados y avalados por la autoridad reguladora», ejemplificó.
Remírez Figueredo apuntó que también se inspecciona el comité de ética que evalúa el protocolo antes de llegar al Cecmed, y emite un dictamen. «Con este comité la autoridad reguladora intercambia sobre qué encontraron en el protocolo, si hubo alguna modificación antes de ser presentado al Cecmed, comprobamos que existe un comité independiente de monitoreo de datos para evaluar la seguridad y eficacia del candidato», refirió la especialista.
Somos evaluadores y también inspectores, refirió Remírez Figueredo, por lo cual que los ensayos clínicos tuviesen lugar en diferentes territorios del país ha representado para el Cecmed un reto, afirmó.
«Hemos realizado inspecciones a todos los ensayos clínicos en La Habana, Granma, Santiago de Cuba y Guantánamo, donde se destacó la participación de la atención primaria de salud», señaló.

Por otra parte, la especialista destacó que se inspeccionó la Empresa Comercializadora de Medicamentos (Encomed), que ha tenido un papel trascendental en el desarrollo de los ensayos clínicos y la intervención sanitaria, en cuanto al manejo, transporte y conservación de los productos de investigación.
«En estas inspecciones siempre dejamos un grupo de recomendaciones, en aras de la mejora continua del proceso, como es la capacitación constante en buenas prácticas clínicas, del personal que participa en los ensayos, en la homogeneización de la documentación, el llenado y la recogida de datos, la historia clínica»¦ Analizamos toda la trazabilidad del proceso», dijo.
La inspección de buenas prácticas clínicas, subrayó, forma parte del dossier que los centros promotores deben preparar para solicitar el autorizo de uso de emergencia.
Remírez Figueredo transmitió a la población el mensaje de que tengan confianza en las decisiones regulatorias que se toman. «La autoridad reguladora cuenta con un equipo sólido, que ha trabajado con tenacidad y responsabilidad durante toda la pandemia», concluyó.
El propósito científico no puede estar por encima de la vida humana

Al intervenir en la Mesa Redonda, Julián Rodríguez Álvarez, secretario de la Comisión Nacional de Ãtica de la Investigación del Minsap, dijo que un comité de ética tiene como misión proteger al sujeto humano que se involucra en una investigación, sobre todo respecto a garantizar sus derechos.
Para ello -apuntó- hay que garantizar todo el cumplimiento de la ciencia desde el punto de vista del diseño de una investigación.
Todo se hace con un equipo formado por profesionales de la salud, abogados y personas que no son profesionales, como miembros de la comunidad, dígase, por ejemplo, amas de casa.
«Los comités de ética muchas veces funcionan como garantes públicos de esos sujetos que participan en la investigación, sobre todo porque son la representación de sus derechos. De ahí su composición multivariada. Se dice que si un miembro de una comunidad de una comisión de ética es capaz de entender y dar su voto de aprobación a una investigación, es la representación de que esa comunidad es posible que entienda lo que se quiere lograr con dicha investigación», explicó.
En ese sentido, -añadió- para funcionar como comité de ética tienes que llevar a cabo dos grandes procesos. «El primero es de aprobación, donde se evalúa y se revisa toda la documentación».
Rodríguez Álvarez se refirió a los principios éticos de la investigación, «que establecen, en primer lugar, el respecto al sujeto, de justicia, equidad y beneficencia, es decir, que realmente la investigación que se está proponiendo tenga un balance riesgo-beneficio que sea adecuado.
«Tienes que evaluar cuáles son los resultados de esa intervención en estudios anteriores o en la investigación de desarrollo previa. Muchas veces, estos órganos, compuestos por varias disciplinas, no tienen toda la experticia y pueden citar a expertos externos».
Todos estos requisitos están planteados en la resolución 40/2014 que es quien rige toda la actividad de los comités de ética.
En el caso de los candidatos vacunales cubanos, aseguró que «ha sido todo un reto. En un primer momento, cuando iniciaron los estudios fase I, empezaron los comités más tradicionales que existen, dígase los institucionales».
Entre ellos, citó al del hospital Saturnino Lora, con más de 10 años de experiencia y compuesto por miembros de amplia permanencia, que atendió los ensayos clínicos fase I y II de Abdala.
«El mayor reto comenzó cuando empezamos de manera compartida a diseñar la estrategia de los ensayos fase III». Rodríguez Álvarez comentó lo complejo que es para un comité institucional dar seguimiento a un ensayo de más de 40 000 personas.
«Ante esa situación la comisión nacional de ética de la investigación del Minsap, dirigida por la doctora Ileana Morales, decidió conformar un comité de ética centralizado que fuese acompañado por los comités de las facultades médicas que atienden los municipios participantes del ensayo clínico», precisó.
¿Por qué deben velar? El experto dijo que, en primer lugar, porque se cumpla el protocolo que se aprobó por la entidad reguladora y el comité de ética, en aras de garantizar el bienestar de los sujetos.
Al referirse a Abdala, señaló que «el reto ahí fue mucho mayor. Hubo que usar métodos no presenciales de videoconferencias e intercambios por correo».
«Nosotros podemos tener hoy una vacuna segura y eficaz, pero esto tiene que estar avalado por un comité de los estándares de ética. El propósito científico no puede estar por encima de la vida humana«.
Rodríguez Álvarez dijo que el proceso de control permitió demostrar que realmente existe una evidencia muy fuerte del cumplimiento de los estándares de ética, tanto de los equipos de investigadores hasta de los médicos, el personal de enfermería y los asistentes.
«Todo esto ha sido un resultado de innovación, pues en el sistema de salud no contábamos con una experiencia anterior. Solo ha sido posible por el alto desarrollo que ha alcanzado nuestro país en materia de ciencia, expresado en los excelentes profesionales con los que hoy contamos», destacó.
Cada requisito evaluado debe quedar documentado

En los minutos finales de la emisión, la subdirectora del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed), Danay Mora Pascual, al referirse a la aprobación del uso de emergencia para los candidatos vacunales, señaló que este es un mecanismo o vía alternativa a lo que es el registro ordinario de una vacuna.
En el caso del candidato vacunal Abdala, ya se presentó la solicitud. «Estamos evaluando el nivel de cumplimiento y calidad de los requisitos técnicos establecidos para obtener este autorizo», dijo.
«Hay una responsabilidad enorme. Todo lo que evaluamos debe quedar documentado y escrito y esa evidencia debe estar disponible, porque además somos objeto de verificación. Ello garantiza que podamos mantener nuestro estatus regulatorio y reconocimiento en el país, que es también el reconocimiento de nuestra ciencia», concluyó.
