CECMED: Regular en pandemia y el desafío de «no equivocarnos»
«De la misma manera que para los científicos fue un reto haber desarrollado los candidatos vacunales, lo ha sido para la autoridad reguladora, porque hemos tenido que acompañar ese proceso desde el inicio con la gran responsabilidad que ello conlleva. Todas las aprobaciones recaen en el CECMED. Y no nos podemos equivocar».
La Máster en Ciencias Olga Lidia Jacobo Casanueva, Directora del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) es enfática: «Trabajar con la dinámica de una pandemia se volvió un desafío», aseveró al iniciar el diálogo con Cubadebate.
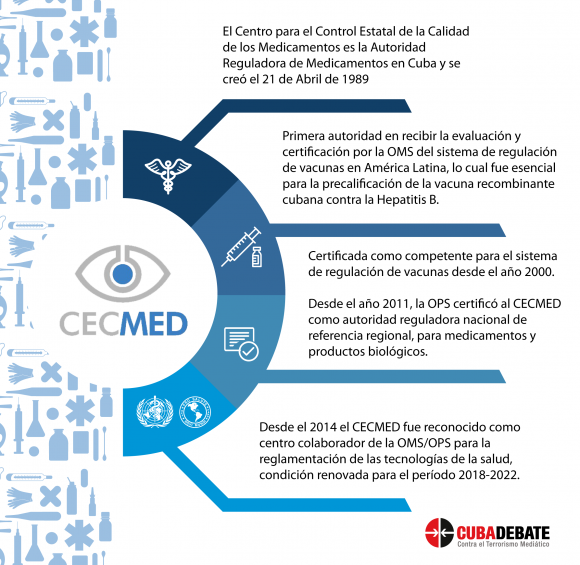
El coronavirus y la covid-19 pusieron a prueba la capacidad de las entidades reguladoras en Cuba, cuyo trabajo, de conjunto con los centros de investigación científica, a lo largo de 30 años ha posibilitado la introducción de productos de primer nivel en el mundo y ha permitido resolver complejas problemáticas sanitarias.
Nunca antes el CECMED enfrentó un escenario similar al que generó el impacto en el país del SARS-CoV-2. Pero tres décadas después de fundada, esta institución demostró estar no solo a la altura, sino que en el peor de los escenarios su misión estaba clara: proteger la salud pública, a través de un sistema regulador capaz de garantizar el acceso oportuno al mercado de productos con calidad, seguridad, eficacia e información veraz para su uso racional.
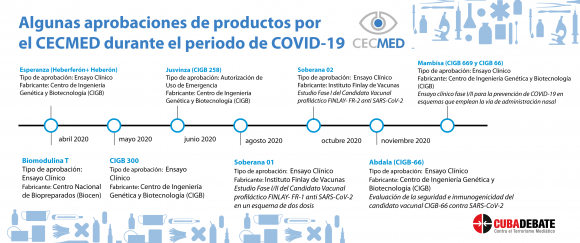
El 23 de marzo de 2020, apenas 12 días después de detectados los primeros casos de covid-19 en el país, el CECMED publicaba en su sitio web una declaración oficial. La nota listaba un número de disposiciones encaminadas a establecer las medidas pertinentes, para mitigar las consecuencias que pudiera traer consigo esta pandemia, en cuanto al impacto en la cadena de suministro, escasez de productos médicos o interrupciones en su investigación y desarrollo.
Desde entonces a la fecha, la autoridad reguladora nacional no se ha detenido un solo día.
Todos los protocolos de investigación de la covid-19 han sido evaluados por el CECMED
Máster en Ciencias Olga Lidia Jacobo Casanueva, Directora del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Foto: Abel Padrón Padilla/ Cubadebate.
«Todos los protocolos de investigación de la covid-19 han pasado por el CECMED», subraya la también licenciada en microbiología, Olga Lidia Jacobo Casanueva.
Explicó la especialista que el Ministerio de Salud Pública, con el comité de innovación y el grupo de expertos que lo componen, han elaborado los protocolos, los cuales van ya por la versión 1.7. «Cada uno de ellos lleva medicamentos y terapias incluidas que pasan por la aprobación de la agencia reguladora. En estos 15 meses hemos debido evaluar y aprobar fármacos, dispositivos médicos y equipos», refirió.

La directora del CECMED, insistió que en que el seguimiento más visible para la población ha estado en los candidatos vacunales, por lo que ello representa, es válido remarcar que la actividad reguladora del centro frente a la covid ha sido amplia.
«Ventiladores, diagnosticadores, medios de cultivo y de transporte, medicamentos como Jusvinza e Itolizumab, que están destinados a pacientes graves y críticos, entre otros productos. Esos dos últimos fueron los primeros medicamentos a los que se les dio el autorizo «»de uso de emergencia», ejemplificó la experta.
Entre los grandes desafíos de esta etapa, la entrevistada mencionó la superación. «La preparación del personal del CECMED es una preparación muy específica y muy especializada, porque tenemos un equipo multidisciplinario que incluye médicos, farmacéuticos, bioquímicos, microbiólogos, médicos veterinario. Preparar a un especialista del CECMED lleva mucho tiempo, porque esta plaza de trabajo no se estudia en ninguna carrera universitaria. La formación es de cero, con una base que se tiene a partir de la carrera universitaria que se estudió. Pero la parte regulatoria, ese conocimiento, lo da trabajar con la autoridad reguladora. Eso se aprende aquí. Entonces, la dinámica es preparar al personal nuevo y hacer el trabajo, y eso ha requerido mucho esfuerzo«, dijo Jacobo Casanueva.
¿Quién aprueba las vacunas?
Como agencia reguladora aportamos varios elementos, comentó la directora del CECMED. «En una pandemia, no podemos comportarnos igual, sino que tenemos que actuar diferente y todo ello implica desafíos para las autoridades reguladoras», sostuvo Jacobo Casanueva.
Una duda frecuente en la población está relacionada con la información de que «hay determinadas vacunas que pasaron el proceso de revisión de la Organización Mundial de la Salud (OMS)».
«Primero, la OMS no es una autoridad reguladora, es un organismo internacional que hace recomendaciones, pero el responsable de aprobar en cada país medicamentos, vacunas, productos biológicos, equipos, todo lo que está regulado, son las autoridades reguladoras nacionales. Esa es una función establecida que es competencia de estas instituciones. Para que una vacuna pase a un proceso de revisión por la OMS, o de precalificación, el primer requisito es que tiene que aprobarse por la autoridad reguladora, y ello no ocurre antes de concluirse los ensayos clínicos fase III», comentó Jacobo Casanueva.
Explicó que la OMS convocó a grupos de expertos internacionales para hacer revisiones de los procesos de las vacunas. «De hecho, el CECMED tiene expertos que han participado en el proceso de revisión de vacunas internacionales a través de la OMS, porque nuestro centro es una entidad de referencia en la región de las Américas. Pero también el CECMED ha sido inspeccionado por la OMS y eso también es importante que la población lo conozca. La capacidad de regulación de nuestra agencia ha sido evaluada por la OMS», puntualizó.
La experta insistió en que cada país tiene una autoridad reguladora encargada de regular, fiscalizar, aprobar, todos los ensayos clínicos, de emitir el uso de emergencia de una vacuna, aprobar su registro sanitario, inspeccionar su sistema productivo y hacer la vigilancia poscomercialización. «Ya tenemos implementado un programa de inspección a las plantas productoras», refirió.
Agregó que no es el CECMED el que presenta al proceso de revisión de la OMS las vacunas, son los fabricantes. «Pero ellos lo hacen cuando entienden que están listos y para eso tienen que pasar por las aprobaciones correspondientes en el país. Cuba tiene condiciones para la precalificación de sus candidatos», señaló.
De acuerdo con Jacobo Casanueva, el CECMED acumula una larga historia evaluando inmunógenos. «Tenemos vacunas precalificadas por la OMS como la antihepatitis B recombinante y la vacuna contra el Haemophilus influenzae tipo b», ejemplificó.
En ese sentido, recordó que en el Instituto Finlay de Vacunas, por ese grupo de científicos, se desarrolló la única vacuna sintética contra el Haemophilus influenzae tipo b en el mundo.
«Son brillantes, tienen talento, y eso hay que reconocerlo. Desarrollaron luego la vacuna contra el neumococo, que todavía no está aprobada porque está en ensayo clínico, el cual se detuvo por la pandemia. Hay talento, tenemos confianza porque hay historia, y el resultado está en las personas que se la pusieron, en los niños que se han vacunado, en cómo se pudo cortar la transmisión. Con todas las limitaciones que tiene el país en este momento, lograr una vacuna en un año, con probada eficacia y en medio de todas las limitantes por el bloqueo, es grandioso.
«El Centro de Ingeniería Genéttica y Biotecnología (CIGB) igual tiene su historia, desarrolló la vacuna contra la hepatitis B y hoy está montada Abdala en esta plataforma, con la cual existe una experiencia previa. Cuando ves los gráficos que muestran cómo estaba la epidemia de hepatitis B en Cuba y cómo bajó con la vacunación, está claro el resultado. También la vacuna pentavalente es un resultado de la ciencia cubana; tenemos esas demostraciones palpables con hechos, datos y resultados», dijo.
Según precisó Jacobo Casanueva, todos los procesos regulatorios referentes a los candidatos vacunales han sido revisados y aprobados con todo el rigor establecido, cumpliendo con las regulaciones vigentes dictaminadas por el CECMED, además de con las recomendaciones que constantemente emiten la OMS, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) y la agencia europea (EMA).
«Ha sido un reto desde el punto de vista regulatorio, porque hemos tenido que evaluar todos los procesos con agilidad, realizar muchos encuentros técnicos con los fabricantes para ir conociendo los procesos antes que lleguen al centro, saber en qué etapa están cada uno de ellos, durante la preclínica y la clínica, de manera que cuando recibimos la información ya tengamos parte de la misma evaluada con anterioridad», aseguró la entrevistada.
Explicó que ya hay inspecciones hechas al sistema productivo, durante la fase de ensayos clínicos, así como durante los estudios de intervención y la actual intervención sanitaria, a partir de un muestreo de los sitios clínicos, los cuales han sido evaluados por especialistas del CECMED.
Doctor Jorge de Jesús Menéndez junto a la directora del CECMED,Olga Lidia Jacobo Casanueva. Foto: Abel Padrón Padilla/ Cubadebate.
El experto en evaluación clínica del CECMED, doctor Jorge de Jesús Menéndez, enfatizó en que a pesar del corto tiempo que ha existido para autorizar los ensayos clínicos, por las propias condiciones que impone la pandemia, «siempre la recomendación a la industria es que trabajen con la mayor calidad posible, es decir, con el estándar más alto que pueda alcanzar en cada momento, y así se les ha exigido».
«Se trata de pensar que este producto no es solo para Cuba, sino también que puede beneficiar a otro grupo de países los cuales, a través de la precalificación y de la evaluación de sus entidades regulatorias, pueden acceder al mismo», dijo.
«Otro elemento a resaltar es que no se ha puesto ni una dosis que no esté bajo protocolo. Todo ha sido autorizado por el CECMED. Siempre se buscó la forma y se decidió que cada ensayo tuviera un protocolo, una aprobación y un seguimiento en inspecciones, en todas las zonas del país donde se han desarrollado», comentó Menéndez.
Subrayó el también epidemiólogo que se ha velado celosamente por la ética, «y no puede haber ética sin un basamento científico. Todos los diseños que se han empleado de forma muy rápida hoy día, son diseños que no eran la norma, lo clásico. La covid-19 revolucionó todo el conocimiento, y por supuesto, el CECMED también tuvo que renovar su conocimiento, empezando por los diseños de ensayo».
En ese sentido, resaltó el rol esencial que han tenido los comités de ética en el desarrollo de los ensayos clínicos, y explicó que un principio ético es no dañar por desconocimiento. Otro es el consentimiento informado, que se le dé información veraz, asequible, potable, a cada voluntario, ejemplificó.
Autorizo de uso de emergencia: Un proceso riguroso
Foto: BioCubaFarma/Twitter.
Luego de que los últimos días acaparara la atención la noticia de que tanto Soberana 02 como Abdala, superaron el 50 % que establece la OMS como requisito para que un candidato vacunal se convierta en vacuna, una interrogante recurrente ha sido cuándo obtienen entonces estos inmunógenos el llamado autorizo de uso de emergencia.
«Para obtener el autorizo de uso de emergencia se requiere cumplimentar una serie de requisitos, que el CECMED ya estableció. Los centros promotores tienen que presentar un expediente con toda la información del producto, que no es solo el dato de la eficacia, sino un compendio de datos de los ensayos, a los que no estamos ajenos porque los hemos ido evaluando en el camino. No obstante, ese expediente se somete a un proceso riguroso de evaluación, si bien el seguimiento anterior a cada etapa nos permite agilizar los procesos», explicó la directora del centro.
«No es la práctica común»subrayó», habitualmente te traen la documentación sin haber presentado el proyecto. La diferencia es que aquí hemos interactuado constantemente con la industria, y al intercambiar con ellos en reuniones y encuentros técnicos, estamos familiarizados con lo que va a venir. Han sido procesos más ágiles pero muy rigurosos y exigentes», aseveró la entrevistada.
Agregó Jacobo Casanueva que, entre los requisitos para obtener el uso de emergencia, los centros promotores, además de presentar este expediente, tienen que tener certificado el proceso productivo con cumplimiento de buenas prácticas de fabricación y ello pasa por una inspección del CECMED. «No se pueden obviar los pasos establecidos, ahora volvemos a verificar que todo se cumpla», dijo.
Evaluadores de la sección de biológicos del CECMED, que incluye especialistas, médicos y farmacéuticos, quienes evalúan calidad y eficacia de los candidatos vacunales. Foto: Abel Padrón Padilla/ Cubadebate.
El camino hasta ahora, coincidieron ambos especialistas, ha sido ágil y transparente, y ha estado acompañado por una entidad que le toca velar y proteger la salud del pueblo, sopesar riesgos y beneficios, alertar, dar luz verde o andar con cautela.
Así lo ha hecho y así lo hará el CECMED, porque la agencia reguladora cubana es una institución sustentada en la ciencia donde el principio de preservar la salud es inquebrantable.